Vaihesääntö, tilakaavioiden rakentaminen. Vaiheen p - V ja t - s tilakaaviot P t x v tilakaaviot
7.2.1 Vaihe p - t... Tarkasteltaessa puhtaan aineen yksittäisiä vaiheita tarkoitetaan yleensä sen aggregaattitiloja: kiinteä, nestemäinen ja kaasumainen... Yleisessä tapauksessa "faasin" käsite on kuitenkin jonkin verran laajempi kuin "aggregaatiotilan" käsite, koska joillakin kiinteässä tilassa olevilla aineilla, esimerkiksi jäällä, hiile, voi olla useita vaiheita.
Vaihemuutos, ts. aineen siirtyminen vaiheesta toiseen, johon liittyy aineen ominaisuuksien muutos, lämmön vapautuminen tai absorbointi (vaihesiirtymälämpö). Usean vaiheen tasapainoinen rinnakkaiselo on mahdollista vain tietyille tilaparametrien yhdistelmille (esimerkiksi lämpötila ja paine). Eri vaiheiden tasapainoisen rinnakkaiselon edellytysten tunteminen on tärkeää esimerkiksi monien teknisten ongelmien ratkaisemisessa. määrittää olosuhteet nesteiden kiehumiselle hydraulijärjestelmissä, arvioida kavitaation esiintymistä pumpuissa jne.
Vaiheiden termodynaamisen tasapainon olosuhteiden analyysi perustuu gibbs-vaihesääntö.Se luo yhteyden riippumattomien tilaparametrien lukumäärän (järjestelmän vapausasteiden) välillä ψ, vaiheiden lukumäärä k ja järjestelmän komponenttien lukumäärä n... Matemaattisesti Gibbsin vaihesääntö muotoillaan seuraavasti:
ψ \u003d n - k + 2.
Puhtaalle aineelle (yksikomponenttinen järjestelmä n \u003d1) Gibbs-vaihesääntö on muotoa:
ψ \u003d 3 - k.
Tässä tapauksessa yksivaiheisella järjestelmällä (kiinteä, nestemäinen tai kaasu) on kaksi vapausastetta, so. kaksi itsenäistä tilaparametriä. Tämä tarkoittaa, että jos asetat mielivaltaisesti kaksi tilaparametriä (esimerkiksi s ja t), niin kaikki muut määritetään yksilöllisesti. Samalla tämä tarkoittaa, että yksivaiheisessa tilassa aine voi esiintyä mielivaltaisilla yhdistelmillä s ja t.
Kaksivaiheinen järjestelmä ( k\u003d 2) on vain yksi vapausaste ( \u003d 1); tässä vain yksi tilaparametri voidaan asettaa mielivaltaisesti. Näin ollen kahden faasin (kiinteä ja nestemäinen, nestemäinen ja kaasumainen, kiinteä ja kaasumainen) tasapainoinen rinnakkaiselo on mahdollista vain tietyllä arvoyhdistelmällä. s ja t;nuo. kukin arvo svastaa hyvin määriteltyä lämpötilaa, jossa faasien rinnakkaiselo on mahdollista.
Päällä kuva 7.2 kuvaa tyypillistä vaihetta s– t kaavio vaiheiden tasapainon viivoilla. Tässä AK on nesteen ja kaasun (höyryn) faasitasapainolinja, АС - kiinteä ja nestemäinen; AB - kiinteän olomuodon ja kaasun linja. Toisin sanoen: AK on höyrystymislinja (kondensaatio), AC on sulamis- (jähmettymis) linja, AB on sublimaatio (desublimaatio) -linja. AK-viivaa kutsutaan myös kyllästysviivaksi, joka päättyy kriittinen piste K... Kolme viivaa leikkaa yhdessä pisteessä A, jota kutsutaan kolminkertainen piste... Tässä vaiheessa on kolme vaihetta samanaikaisesti, koska Gibbsin vaihesäännön mukaan k \u003d 3, yksikomponenttisen järjestelmän vapausasteiden lukumäärä on nolla ( ψ \u003d 0). Esimerkiksi vedelle kolminkertaisessa pisteessä s A = 616 Pa, t A \u003d 0,01 ° C ja hiilidioksidille s A \u003d 0,518 MPa, t A \u003d - 56,7 ° C
Vaihekaavion avulla on mahdollista selvittää, missä tilassa (kiinteä, nestemäinen, kaasumainen, kaksi- tai kolmivaiheinen) tietty aine on annetuilla arvoilla s ja t... Lisäksi vaihekaaviota voidaan käyttää vaihesiirtymälämpötilan määrittämiseen tietyllä paineella ja päinvastoin.
Vaihekaavio määrittää myös aineen siirtymisen luonteen tilasta toiseen. Esimerkiksi s 1 > p A siirtyminen kiinteästä tilasta kaasumaiseen tilaan tapahtuu nestemäisen tilan kautta. Paineen alla s 2< p А aineen olemassaolo nestemäisessä tilassa on mahdotonta; tässä kiinteä faasi muuttuu kaasumaiseksi, ohittaen nestevaiheen. Samanaikaisesti paineissa, jotka ylittävät paineen kriittisessä pisteessä, kaasumaisten ja nestefaasien rinnakkaiselo on mahdotonta, ja lämpötiloissa, jotka ylittävät lämpötilan kriittisessä pisteessä (katso alla), aine esiintyy vain kaasumaisessa (höyry) vaiheessa.
7.2.2 Vaihe p - v... Prosessit todellisen kaasun parametrien muuttamiseksi vaihesiirtymän aikana nestehöyry selkeimmin voidaan esittää käyttämällä s–v kaaviot ( kuva 7.3).
Tässä kaaviossa kahden vaiheen ("neste - höyry") tasapainotasoa ei ole kuvattu viivalla, vaan se vie tietyn alueen. Tässä voidaan erottaa kolme aluetta: I - nestemäinen tila, II - kaksivaiheinen tila (faasitasapaino "nestehöyry") ja III - kaasumainen (höyry) tila. MK-käyrä on niiden pisteiden sijainti, jotka määrittävät kiehumispisteeseen (kylläisyydeksi) kuumennetun nesteen tilan sopivalla paineella. Se erottaa nestemäisen alueen kyllästetystä höyryalueesta ja sitä kutsutaan nesteen rajakäyräksi (tässä x = 0).
NK-käyrän pisteet määrittävät tilan kuiva kylläinen höyry. Tämä käyrä erottaa tyydyttyneen höyryalueen ylikuumentuneesta höyryalueesta ja sitä kutsutaan rajakäyrän höyry; tässä x \u003d 1,0. Päällä p-v-kaavio kaksivaiheisen tilan alueella, höyrykuivaavat vakiot ovat piirretty ( x 1 ; x 2 jne.). Paineen noustessa ja vastaavasti lämpötilassa, jossa vaihemuutos tapahtuu, kiehuvan nesteen ominaismäärä kasvaa ja tyydyttyneen höyryn ominaismäärä pienenee. Tietyllä paineella, joka on melko selvä kullekin aineelle, rajakäyrät yhtyvät pisteeseen TO, jota kutsutaan kriittinen piste.
Päällä kuva 7.3 useita isotermejä ( T \u003d vakio)... On havaittu, että ylikuumentuneen alueen isotermillä on muoto, joka on lähellä ihanteellisen kaasun muotoa. Aineen kaksivaiheisen tilan ("neste - höyry") alueella isotermi on samanaikaisesti isobaari. Tämä seuraa suoraan Gibbsin vaihesäännöstä, jonka mukaan kaksivaiheisella yksikomponenttisella järjestelmällä on vain yksi vapausaste. Nestemäisen tilan alueella paineen nousu johtaa merkityksettömään muutokseen nesteen tilavuudessa matalan kokoonpuristuvuuden vuoksi. Kriittisessä lämpötilassa vaakasuora osa muuttuu pisteeksi (kriittinen piste), joka on tämän isotermin taivutuspiste. Aineen tilalle tässä vaiheessa on tunnusomaista kriittiset parametrit: paine r k, lämpötila T tiettyyn tilavuuteen v j. Joidenkin aineiden kriittiset parametrit on annettu taulukossa 7.1.
Taulukko 7.1 Joidenkin aineiden kriittiset parametrit
Kriittinen piste Kkuuluu samanaikaisesti molempiin rajakäyriin ja vastaa aineen tilaa, jossa nesteen ja höyryn välillä ei ole eroa. Tätä kuvaa höyrystymislämmön riippuvuus veden lämpötilasta ( kuva 7.4), josta voidaan nähdä, että kriittisessä kohdassa höyrystymislämpö tulee nollaksi ( r\u003d 0). Kriittisen arvon ylittävissä lämpötiloissa isotermeillä ei ole vaakasuoria leikkauksia. Näissä lämpötiloissa aine on missä tahansa paineessa höyryisessä (kaasumaisessa) tilassa, ja isotermien muoto lämpötilan noustessa lähestyy ihanteellisen kaasun isotermeja.
Of s– vkaavio seuraa tärkeätä johtopäätöstä nesteen höyryksi muuttumisen erilaisesta luonteesta eri paineissa. Alikriittisissä paineissa, kun nesteeseen syötetään lämpöä, neste kuumennetaan kiehumispisteeseen, höyrystyminen, jonka aikana aine on kaksivaiheisessa tilassa, ja höyry ylikuumentuu. Ylikriittisissä paineissa (linja x - y) siirtyminen nesteestä kaasumaiseen tilaan tapahtuu jatkuvasti ohittaen kaksivaiheisen tilan. Tässä tapauksessa raja nestemäisen ja kaasumaisen faasin välillä on mielivaltainen.
Kun neste siirtyy höyryyn alikriittisissä paineissa, tapahtuu äkillinen muutos aineen ominaisuuksissa. Kuten seuraa kuva 7.5, joka osoittaa vedyn tiheyden riippuvuuden lämpötilasta kahdessa paineessa, ylikriittisessä paineessa tämä prosessi etenee jatkuvasti erilaisten nesteiden ja höyryjen välillä. Tämä on pidettävä mielessä suunniteltaessa ja analysoitaessa teknisten laitteiden toimintaa, joissa vaihesiirtymät ovat mahdollisia (lämmönvaihtimet, jäähdytysjärjestelmät, jäähdytysyksiköt, voimalaitosten höyrynkehittimet).
Aineen kriittisten parametrien avulla voidaan määrittää vakiot a ja bvan der Waltz -yhtälössä: a \u003d27 R 2 T 2 k / 64 P k , b \u003dR T k / 8 P k R \u003d8 P k v k / 3 T k. Aineen parametreja, joita viitataan vastaaviin kriittisessä tilassa oleviin parametreihin, kutsutaan annetut parametrit:
Tässä p k, T k - tietyn aineen paineen ja lämpötilan kriittiset arvot. Annettujen parametrien avulla van der Waalsin yhtälö voidaan kirjoittaa seuraavassa muodossa, jota kutsutaan pelkistetty van der Waalsin tilayhtälö. Kaikilla kriittisen pisteen aineilla annetuilla parametreillä on sama arvo, joka on yhtä suuri kuin yhtenäisyys.
Käytännön laskelmissa, joiden virhe on 15%, todellisen kaasun tilayhtälöä voidaan käyttää seuraavassa muodossa:
p υ \u003d z ∙ R ∙ T,(7.2)
joka on johdettu vastaavien valtioiden laki... Tässä z- puristuskerroin paineesta riippuen sja lämpötila T ja määritettiin kokeellisesti. Kokeellisten tietojen analyysin perusteella todettiin, että toiminto tietyllä tarkkuudella z \u003d z (π, τ) on universaali, ts. riittävän yleisiä eri aineille. Tiettyyn aineeseen se voidaan määrittää z: stä -π kaavio kuva 7.6.
Asenne z k \u003d R T k / p kv kkriittisessä kohdassa kutsutaan kriittinen kerroin ja ottaen huomioon yllä olevat kriittisten parametrien suhteet ( a, b, R) on vakio ja yhtä suuri kuin 8/3 \u003d 2,67.
Seuraavaksi peräkkäin analysoimme vaihetasapainokaavion, jossa komponenttien liukoisuus on rajoitettu kiinteässä tilassa ja eutektinen muutos... Eutektisissa järjestelmissä yhden komponentin ensimmäisten määrien lisääminen toiseen aiheuttaa seoksen lämpötilan laskun niin, että nestekäyrä kulkee eutektiseksi pisteeksi kutsutun lämpötilan minimin läpi. Nesteellä on liukoisuus mihin tahansa osuuteen, ja liukoisuus kiinteässä tilassa on rajallinen.
Eutektisen transformaation seurauksena muodostuu hyvin pienikokoisia kiteitä, joita ei voida erottaa optisessa mikroskoopissa. Tästä syystä eri faasikomponentit, jotka muodostuvat muunnoksen seurauksena, yhdistetään yhdeksi rakennekomponentiksi.
Esimerkki vaihekaaviosta eutektisella muunnoksella on esitetty kuvassa. A- ja p-faasit ovat kiinteitä liuoksia. Ilmaisua "rajoitetut kiinteät liuokset" voidaan soveltaa näihin ratkaisuihin, koska kunkin liuoksen stabiilisuusalue ulottuu vain osaan kaaviota. Näitä vaiheita voidaan kutsua myös ensisijaisiksi kiinteiksi ratkaisuiksi, koska niitä vastaavat alueet alkavat kaavion reunoista (sen sisällä), eivätkä ne ole rajoittuneet molemmilta puolilta jonnekin kaavion keskelle. Vaiheilla voi olla sama kiderakenne, mutta tämä ei ole välttämätöntä; jokaisella vaiheella on sen komponentin rakenne, jonka kanssa se rajoittuu. Kiinteiden ratkaisujen rakenteelle ei ole asetettu rajoituksia; ne voivat olla sekä korvaavia että interstitiaalisia ratkaisuja.
Kuvassa on kolme kaksivaiheista aluetta:L + a, L + β ja α + β. Ilmeisesti alueetL + a ja L + β ovat kaikissa suhteissa pinta-alaa vastaavatL + α-kaaviot komponenttien rajoittamattomalla liukoisuudella, joista keskustelimme tämän artikkelin ensimmäisessä osassa. Näiden alueiden voidaan katsoa muodostuvan kodeista, jotka yhdistävät kussakin annetussa lämpötilassa nestemäisen ja kiinteän faasin koostumukset, joita edustavat viivat solidus ja liquidus. Samoin a + p-alueen katsotaan muodostuvan konodeista, jotka yhdistävät kussakin lämpötilassa a-faasin koostumuksen a-liukoisuuskäyrällä vastaavaan p-faasin koostumukseen p-liukoisuuskäyrällä.
Kolme kaksivaiheista aluetta on kytketty toisiinsa konodilla (a - e - b ), joka on yhteinen kaikille niille ja yhdistää kolmen konjugaattivaiheen koostumukset, jotka esiintyvät samanaikaisesti eutektisessa lämpötilassa, ts.a ), nesteet (kohtae) ja β (kohta b ). Tätä viivaa kutsutaan myös eutektiseksi viivaksi tai eutektiseksi vaakasuoraksi tai isotermiseksi reaktioksi. Pistee , joka on ainoa neste, joka voi esiintyä samanaikaisesti molempien kiinteiden faasien kanssa, kutsutaan eutektiseksi pisteeksi, toisin sanoen seoksen pistekoostumukseksi, jolla on alin sulamispiste.
Kiinteän liuoksen yhteydessä tapahtuvaa eutektista transformaatiota kutsutaan eutektoidimuunnokseksi.
Artikkelin kolmannessa osassa jatkamme vaiheiden tasapainokaavioiden tarkastelua.
Yksikomponenttinen heterogeeninen järjestelmä on yksi aine eri aggregaatiotiloissa tai polymorfisissa modifikaatioissa. Gibbs-vaihesäännön mukaisesti, kun K \u003d 1, C \u003d 3 F. Ottaen huomioon, että fyysisen merkityksen C0 mukaan on selvää, että 3, so. yksikomponenttisen heterogeenisen järjestelmän samanaikaisesti olemassa olevien vaiheiden määrä voi olla enintään kolme. Polymorfismin puuttuessa nämä ovat nestemäisiä, kiinteitä ja höyryfaaseja. Kaksivaiheiset tasapainot, jotka ovat mahdollisia tällaisessa järjestelmässä, ovat "neste - höyry", "kiinteä - höyry" ja "kiinteä - neste". Kullekin näistä tasapainoista on tunnusomaista tietty suhde parametrien P ja T välillä, jotka Clapeyron-Clausius-yhtälöt ovat vahvistaneet vastaaville prosesseille: haihdutus, sublimaatio ja sulaminen.
Nämä suhteet voidaan vahvistaa myös empiirisesti fysikaalis-kemiallisen analyysin menetelmillä. Ne on kuvattu graafisesti paineen ja lämpötilan koordinaatti-akseleissa käyrien muodossa P \u003d f (T).
Graafinen esitys vaiheiden tasapainotiloista eri P: llä ja T: llä kutsutaan tilakaavio tai vaihekaavio... Tarkastellaan esimerkiksi veden ja rikin faasikaavioita.
4.5.1. Veden vaihekaavio
Veden tilaa on tutkittu monenlaisissa lämpötiloissa ja paineissa. Tiedetään, että korkeissa paineissa jää voi olla erilaisissa kiteisissä muunnoksissa fysikaalisista olosuhteista (P ja T) riippuen. Tämä ilmiö, jota kutsutaan polymorfismiksi, on luontainen monille muille aineille. Harkitaan kaaviota veden tilasta matalissa paineissa (jopa 2000 atm).
Kaaviossa on kolme vaihekenttää ( kuva 4.1):
AOB-nestekenttä,
VOS (käyrän alla) tyydyttymättömän höyryn kenttä,
AOC on kiinteän faasin kenttä.
Kuva: 4.1. Veden vaihekaavio
Missä tahansa kentän pisteessä järjestelmä on yksivaiheinen ja vaihteleva (K \u003d 1; Ф \u003d 1; C \u003d 2), ts. tietyissä rajoissa lämpötilaa ja painetta voidaan muuttaa muuttamatta vaiheiden määrää ja niiden luonnetta. Esimerkiksi kohta 1 vastaa nestemäistä vettä, jolla on parametrit t 1 ja Р 1.
Jos järjestelmässä on kaksi tasapainossa olevaa vaihetta, K \u003d 1; F \u003d 2; C \u003d 1, ts. järjestelmä on yksivaiheinen. Tämä tarkoittaa, että yhtä parametria voidaan muuttaa mielivaltaisesti tietyissä rajoissa, kun taas toisen täytyy muuttua ensimmäisestä riippuen. Tämä riippuvuus ilmaistaan \u200b\u200bkäyrällä Р \u003d f (Т): Höyrystyskäyrä (tai kondensaatiokäyrä); OS-sublimaatiokäyrä (tai sublimaatio); AO-sulamiskäyrä. Esimerkiksi kohta 2 kuvaa tasapainojärjestelmää, jossa vesi ja tyydyttynyt vesihöyry ovat tasapainossa lämpötilassa t2 ja paineessa Р2. Jos Р 2 \u003d 1 atm, niin t 2 kutsutaan normaaliksi kiehumispisteeksi.
OM-veden haihtumiskäyrä hajoaa kriittisessä pisteessä (B) t \u003d 374С ja Р \u003d 218 atm. Tämän pisteen yläpuolella nestemäinen ja höyryinen vesi eivät ole ominaisuuksiltaan erotettavissa. Tämän perusti D.I. Mendelejev vuonna 1860
AR-jään sulamiskäyrällä paineissa 2047 atm on vasemmanpuoleinen kaltevuus, joka vastaa ehtoa V f.p.< 0 (мольный объем льда > moolitilavuus vettä). Tällainen jää on vettä kevyempi, se kelluu vedessä, joten elävät organismit säilyvät luonnollisissa säiliöissä, jotka eivät jääty pohjaan. Suuremmissa paineissa jää muuttuu tiheämmiksi modifikaatioiksi, sitten AO-sulamiskäyrä kallistuu oikealle. Jäätä tunnetaan seitsemän kiteistä modifikaatiota, joista kuuden tiheys on suurempi kuin nestemäisen veden. Viimeinen niistä ilmestyy 21680 atm: n paineessa. Yhden jään muodon muuntuminen toiseen on enantiotrooppinen siirtymä (katso alla polymorfismista).
Pisteviiva käyrä ОD (jatkoa ОВ) kuvaa metastabiilia tasapainoa: ylijäähdytetty vesi ↔ kyllästetty höyry.
Metastabiili kutsutaan tasapainoja, joissa on kaikki faasitasapainon ulkoiset merkit, mutta järjestelmän isobaarinen potentiaali ei ole saavuttanut absoluuttista minimiarvoa ja voi laskea edelleen.Epäpuhtauksista kiteytyvä vesi muuttuu jääksi. Piste Kolme pistettä. Sen koordinaatit vedelle ilman poissa ollessa: P \u003d 4,579 mm Hg. Art., T \u003d 0,01 ° C. Ilman läsnä ollessa 1 atm, nämä kolme faasia ovat tasapainossa 0 ° C: ssa. Tässä tapauksessa kokonaispaine on 1 atm, mutta vesihöyryn osapaine on 4,579 mm Hg. Taide. Jäätymispisteen lasku 0,01º johtuu kahdesta syystä: ilman liukoisuus veteen (katso kohta "Liuosten jäätymispisteen alentaminen") ja kokonaispaineen vaikutus nesteiden jäätymispisteeseen (järjestelmän kokonaispaineen nousu alentaa sitä). Tämä on ainoa kohta, jossa kaikki kolme vaihetta ovat tasapainossa: vesi, jää ja höyry. Tässä vaiheessa järjestelmä on muuttumaton: C \u003d 0.
VAIHESUUNNITELMA, graafinen esitys olosuhteista (lämpötila, paine, kemiallinen koostumus jne.), Joissa tasapainotermodynaamisessa järjestelmässä, joka koostuu yhdestä tai useammasta määritellystä aineesta (järjestelmän itsenäisistä komponenteista), esiintyy homogeenisia aineen (vaiheita) fyysisiä ja kemiallisia eroja ominaisuudet. Termin "vaihekaavio" vastineena käytetään termiä "tilakaavio" (pääasiassa Venäjällä ja Saksassa). Tilakuvaa kutsutaan kuitenkin usein, erityisesti englanninkielisessä kirjallisuudessa, kaavioiksi, jotka eivät suoraan heijasta vaihetasapainoa järjestelmässä.
Vaiheet esitetään vaihekaaviossa alueina, joita rajaavat käyrät tai pinnat, jotka sijaitsevat itsenäisten termodynaamisten muuttujien tilassa. Yleensä nämä ovat lämpötila T, paine P, järjestelmän komponenttien moolijakeet x, näiden ja muiden muuttujien toiminnot, kuten komponenttien määrien tai konsentraatioiden suhteet, tiheydet p tai moolitilavuudet V m, osapaineet tai aineiden kemialliset potentiaalit μ. Jos ulkoisia voimakenttiä ei ole, vaihe-avoimen järjestelmän täydellisen kaavion ja komponenttien koordinaattiakselien määrä on yhtä suuri kuin c + 2. Moniulotteisten vaihekaavioiden näyttämiseksi tasossa käytetään niiden osia ja projektioita, jotka on rakennettu tietyille rajoituksille, jotka on asetettu joillekin itsenäisille muuttujille, usein yhdessä erityisesti valittujen koordinaattijärjestelmien (Jenike-koordinaatit, Gibbs - Rosebohm-kolmiot jne.) Kanssa. Vaihekaavio osoittaa: mitkä yksittäiset aineet, nestemäiset, kiinteät tai kaasumaiset liuokset muodostavat järjestelmän tietyt komponentit; missä olosuhteissa tällaiset faasit ja niiden heterogeeniset seokset ovat termodynaamisesti stabiileja; millaisilla termodynaamisten muuttujien arvoilla tapahtuu järjestelmävaiheessa aineen muunnoksia. Vaihekaaviot, jotka sisältävät tietoja faasien kemiallisesta koostumuksesta, mahdollistavat myös samanaikaisten faasien suhteellisten määrien määrittämisen. Tällaiset tiedot ovat välttämättömiä monien tieteellisten ja käytännön ongelmien ratkaisemiseksi, ja niitä käytetään laajalti kemiassa, metallurgiassa, materiaalitieteessä, geokemiassa ja muilla tieteen ja tekniikan aloilla.
Vaihekaavion koordinaatit voivat olla kahden tyyppisiä termodynaamisia muuttujia - termisen, mekaanisen ja kemiallisen tasapainon parametrit T, P, μ, joilla on samat arvot tasapainojärjestelmän kaikissa osissa, tai (yleensä eri vaiheissa erilaiset) yleiset tiheydet, joilla on laaja ominaisuus, kuten x, p , V m ja muut ominaisuudet, jotka vastaavat suurten määrien suhdetta järjestelmän aineen määrään, massaan tai tilavuuteen. Tässä suhteessa erotetaan kolme vaihekaaviotyyppiä. Samantyyppiset kaaviot ovat isomorfisia: niillä on samat topologiset ominaisuudet riippumatta komponenttien lukumäärästä ja tiettyjen muuttujien arvoista koordinaattiakseleilla.
Vaihetyyppien (T, P), (T, μ i), (μ i, μ j) ja vastaavien kaavioissa, joissa on voimakkaat tasapainoparametrit, esitetään vain niitä erottavat vaihe-alueet ja linjat (pinnat), jotka merkitsevät yksittäisten vakausrajat vaiheet. Suorien leikkauspisteet vastaavat tasapainotiloja useammalle kuin kahdelle vaiheelle. Täten kolmikerta yksikomponenttisen järjestelmän (T, P) -diagrammin kohdalla osoittaa kolmen vaiheen vakaan rinnakkaiselon olosuhteet.
Pitoisuuksien, molaaristen ominaisuuksien, tiheyksien akselin läsnä ollessa, kuten esimerkiksi vaihekaaviossa (T, x), (P, x), (μ i, x), (T, p), vaiheen stabiilisuusalueet erotetaan toisilla alueilla, jotka heijastavat tasapainovaiheiden heterogeenisten seosten olemassaoloa. Tämän tyyppinen vaihekaavio kaksikomponenttiselle kadmium-sinkkijärjestelmälle on esitetty kuvassa. Tämän kaksikomponenttisen järjestelmän kaaviossa on kaksi koordinaattiakselia eikä neljä, kuten edellinen lauseke + 2 edellyttää, koska P: n vakauden ehtoa käytettiin sen rakentamisessa ja kaksi riippumatonta muuttujaa Cd: n ja Zn: n määrästä korvataan yhdellä konsentraatiolla x Zn (x Cd \u003d 1 - x Zn). Kuvan yläosa on nesteen ja höyryn tasapainokaavio. Puhtaiden komponenttien sulamispisteitä yhdistävää rikkoutunutta käyrää kutsutaan likvidusviivaksi; se näyttää järjestelmän "sulamiskaavion". Suorat viivat (viivat), jotka on piirretty tällaisen vaihekaavion heterogeeniselle alueelle kahden samanaikaisesti olemassa olevan vaiheen rajojen välillä pitoisuusakselin suuntaisesti (katso kuvassa eutektinen viiva), antavat järjestelmän minkä tahansa komponenttikokoonpanon määrittää samanaikaisesti esiintyvien vaiheiden lukumäärän ("vipusääntö").
Kolmannen tyypin vaihekaaviossa - (x i, x j), (x i, p), (molaarinen entropia, x), (molaarinen entalpia, x) jne. - koordinaatit ovat vain yleisiä tiheyksiä, joilla on laaja termodynaaminen ominaisuus. Nämä kaaviot esittävät myös heterogeenisiä faasien ja päiden seoksia, mutta toisin kuin kaksi muuta vaihekaaviotyyppiä, tässä tapauksessa heterogeenisten seosten tila näytetään tasaisella tai tilavuusluvulla (kolmio, tetraedri) ja on mahdollista määrittää järjestelmän kvantitatiivinen faasikoostumus tasapainossa kolme ja enemmän vaiheita (kuvan "painopisteen sääntö").
Vaihekaaviot tutkitaan kokeellisesti ja lasketaan kemiallisen termodynamiikan menetelmillä järjestelmän muodostavien aineiden termodynaamisten ominaisuuksien tiedoista. Teoreettisen perustan vaihekaavioiden rakentamiselle antoi J. Gibbs 1880-luvulla. Hän muotoili myös "vaihesäännön" (katso Gibbsin vaihesääntö), jota käytetään laajalti vaihetasapainojen ja vaihekaavioiden kokeellisessa tutkimuksessa: kiinteillä T: llä ja P: llä tasapainossa olevien vaiheiden f määrä ei voi ylittää järjestelmän komponenttien lukumäärää enemmän kuin kahdella, f ≤ c + 2.
Kirjoitettu: Palatnik L.S., Landau A.I. faasitasapaino monikomponenttijärjestelmissä. Khar., 1961; Kaufman L., Bernstein H. [metallijärjestelmien] tilakaavioiden laskeminen tietokoneella. M., 1972; Fyysinen metallurgia / Toimittanut R. Kahn, P. Haazen. M., 1987., osa 2.
Todelliset kemialliset aineet, joita on käytännössä käsiteltävä, ja jopa alipuolijohteiden Ge ja Si ultrapuhtaat kiteet sisältävät aina jäännösepäpuhtauksia, eli ne ovat aina aineita, jotka koostuvat useista kemiallisista alkuaineista. Tietyn materiaalin muodostavien kemiallisten alkuaineiden vuorovaikutus voi olla hyvin monimutkaista. Tämän vuorovaikutuksen erityinen tulos riippuu vuorovaikutuksessa olevien elementtien kristallikemiallisesta luonteesta, niiden pitoisuudesta sekä ulkoisista tekijöistä - lämpötilasta ja paineesta.
Päämenetelmät tietyn aineen muodostavien kemiallisten alkuaineiden tai yhdisteiden vuorovaikutuksen tulosten kuvaamiseksi ovat järjestelmän tilakaaviot. Tilakaavio osoittaa vakaat tilat, toisin sanoen, että tietyissä olosuhteissa on vähintään vapaa energia. Siksi tilakaaviota voidaan kutsua myös vaihetasapainokaavioksi, koska se osoittaa, mitkä tasapainovaiheet ovat olemassa tietyissä olosuhteissa. Tämän mukaisesti kaaviossa heijastuvat järjestelmän tilan muutokset viittaavat tasapainotiloihin, toisin sanoen jos järjestelmässä ei ole hypotermiaa tai ylikylläisyyttä. Vaihemuutoksia ei kuitenkaan voi tapahtua tasapainotiloissa (katso alla), joten vaihekaavio on teoreettinen tapaus. Vaihekaavioiden rooli eri kemikaalien vuorovaikutuksen luonteen ja tulosten ymmärtämisessä ja näiden tulosten ennustamisessa on kuitenkin erittäin tärkeä, koska vuorovaikutuksen luonne määrää saadun materiaalin ominaisuudet. Käytännössä vaihekaavioita käytetään muunnosten huomioon ottamiseksi pienillä jäähdytys- tai lämmitysnopeuksilla.
Tilakaaviojärjestelmä on geometrinen kuva yhden tai monikomponenttisen termodynaamisen järjestelmän tasapainovaiheen tiloista näiden tilojen määrittävien parametrien (pitoisuus, lämpötila, paine) funktiona.
Määritellään joitain käsitteitä, joita käytetään tilakaavioiden kuvauksessa.
Termodynaaminen järjestelmäkutsutaan makroskooppisten ulottuvuuksien kappaleeksi (kappaleiden joukoksi), jonka yksittäisten osien välillä (välillä
jolle) järjestelmän ainakin yhden komponentin lämmönsiirto ja diffuusio on mahdollinen ja mihin (mitkä) termodynamiikan periaatteet ovat voimassa.
Termodynaamiset järjestelmät on jaettu homogeeninenja heterogeeninen. Homogeeninenkutsutaan termodynaamista järjestelmää, jonka sisällä järjestelmän osia toisistaan \u200b\u200berottavien vaiheiden välillä ei ole rajapintoja, jotka poikkeavat joko kiderakenteesta tai fysikaalisista ja kemiallisista ominaisuuksista. Heterogeeninenjärjestelmä koostuu osista, joilla on joko erilainen rakenne tai erilaiset fysikaalis-kemialliset ominaisuudet ja jotka on erotettu toisistaan \u200b\u200brajapinnoilla. Esimerkki heterogeenisestä järjestelmästä on vesi,
tasapainossa höyryn kanssa.
Vaiheon homogeeninen järjestelmä tai järjestelmä, joka on joukko homogeenisia järjestelmiä, identtisiä kiderakenteella ja fysikaalis-kemiallisilla ominaisuuksilla, erotettu toisistaan \u200b\u200brajapinnoilla. Edellä olevassa esimerkissä faasit ovat vesi ja höyry, jotka eroavat esimerkiksi tiheydeltään.
Vaiheiden väliset rajapinnat ovat äärellisen paksuja kerroksia, joissa ainakin yksi järjestelmän parametreista vaihtuu suunnasta vaiheesta toiseen. Vaiheiden välisillä rajapinnoilla suhteessa vierekkäisiin vaiheisiin on liikaa energiaa (pintajännityksen energia).
Kiinteille aineille vaiheen tärkein piirre on sen kristallihila.1 Jokaisella kiinteällä faasilla on oma kristallihila, joka on luontainen vain sille, joka eroaa muiden vaiheiden hiloista joko tyypin tai parametrien mukaan. Kiinteä kiteinen faasi voidaan saada yksikiteisen tai monikiteisen muodon muodossa, joka on kokoelma jyviä tai kristalliitteja. Avaruudessa eri suuntiin suuntautuvan monikiteisen kiteytykset erotetaan toisistaan \u200b\u200buseiden atomikerrosten rajapinnoilla (katso luku 3). Viljarajat eivät tietenkään ole välivaiheita.
Termodynaamiset järjestelmät voivat olla yksi- tai monikomponenttisia.
Järjestelmän komponenttikutsutaan järjestelmän osaksi, jonka määrä voi vaihdella muiden osien lukumäärästä riippumatta. Meidän tapauksessamme järjestelmän komponentit voivat olla kemiallisia alkuaineita tai yhdisteitä. Yleisesti ottaen järjestelmän komponenttien lukumäärä ei välttämättä ole
Kiinteä faasi voi periaatteessa olla myös amorfinen tai lasimainen. Molemmille näistä vaiheista on ominaista pitkän matkan järjestyksen puuttuminen atomien järjestelystä, pikemminkin kuin neste. Tässä tarkastellaan vain kiteisiä materiaaleja.

Kuva: 4.1. Ge - Si - järjestelmän tilakaavio.
on yhtä suuri kuin järjestelmän erilaisten kemiallisten alkuaineiden lukumäärä. Esimerkiksi vesi (H2O) koostuu vedystä ja hapesta, mutta tämä on yksikomponenttinen järjestelmä. Kuvassa 4.1 ja kuva. Kuvassa 4.2 on esitetty kahden tyypillisen kaksikomponenttisen (binaarisen) puolijohdejärjestelmän - Ge - Si ja InSb - AlSb - vaihetasapainokaaviot. Ensimmäisessä tapauksessa järjestelmän komponentit ovat Ge ja Si ja toisessa InSb ja AlSb, eivät Sb, Al, In, koska järjestelmän In ja Al määrä riippuvat Sb: n määrästä ja InSb: n määrä ei riipu AlSb: n määrästä. siksi järjestelmän komponenttien määräon kemikaalien vähimmäismäärä, joka tarvitaan tietyn järjestelmän minkä tahansa vaiheen muodostamiseen.
Järjestelmän termodynaamisesti tasapainotila on sellainen tila, jossa tämän tilan parametrit eivät muutu ajan myötä ja järjestelmässä ei ole minkään tyyppisiä virtauksia.
Järjestelmän tasapainotila voi olla yksivaiheinen, kaksivaiheinen ja monivaiheinen. Kun sekoitetaan vähintään kaksi kiinteää faasia, kiinteät liuokset, yhdisteet ja mekaaniset seokset... Jälkimmäinen toteutuu, jos nämä vaiheet eivät ole vuorovaikutuksessa toistensa kanssa. Seoksen muodostavat faasit voivat olla alkuaineita, yhdisteitä tai niihin perustuvia kiinteitä liuoksia sekä saman kemiallisen alkuaineen (a ja β-tina jne.) Allotrooppisia modifikaatioita. Suurin mahdollinen vaiheiden määrä tasapainossa määräytyy Gibbsin vaihesäännön mukaan. Vaihesääntö vahvistaa yhteyden

Kuva: 4.2. InSb - AlSb-järjestelmän tilakaavio.
järjestelmän vaiheiden, komponenttien ja vapausasteiden lukumäärällä:
c= k− f+ 2, (4.1)
missä c- järjestelmän vapausasteiden määrä, k- järjestelmän komponenttien lukumäärä fon järjestelmän vaiheiden lukumäärä.
Alla määrä vapausasteitajärjestelmät ymmärtävät ulkoisten ja sisäisten parametrien määrän (lämpötila, paine ja pitoisuus), joita voidaan muuttaa muuttamatta järjestelmän vaiheiden lukumäärää. Jos vapausasteiden lukumäärä on nolla, järjestelmän ulkoisia ja sisäisiä parametreja on mahdotonta muuttaa aiheuttamatta vaihemäärän muutosta. Jos vapausasteiden lukumäärä on yhtä suuri, muutos jonkin parametrin tietyissä rajoissa on mahdollinen, mikä ei aiheuta vaiheiden määrän vähenemistä tai kasvua.
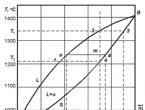
Tarkastellaan esimerkiksi puhtaan aineen (alkupuolijohde) kiteytymistä vakiopaineessa. Tässä tapauksessa Gibbsin sääntö on muoto c= k− f+ 1.2 Kun puolijohde
on nestemäisessä tilassa, eli f\u003d 1, vapausasteiden lukumäärä on 1 ( c= k− f+1 \u003d 1 - 1 + 1 \u003d 1). Lämpötila voi tässä tapauksessa olla
muuttaa muuttamatta aggregaation tilaa. Kiteytymisen hetkellä
f\u003d 2 (kaksi faasia - kiinteä ja nestemäinen), c= k− f+1 \u003d 1-2 + 1 \u003d 0. Tämä
tarkoittaa, että nämä kaksi vaihetta ovat tasapainossa tiukasti määritellyn kanssa
2 Gibbs-yhtälön itsenäiset muuttujat ovat pitoisuus, lämpötila ja paine. Jos paine on vakio, yhtälön muuttujien määrä vähenee yhdellä.
lämpötila (sulamislämpötila), eikä sitä voida muuttaa ennen kuin jokin vaiheista katoaa (lämpötila-aika-kaaviossa näkyy kohta T\u003d const, jonka pituus on sama kuin aika kiteytymisen alusta loppuun). Tässä tapauksessa vakiolämpötilan ylläpitämisen lähde on piilevä kiteytyslämpösama kuin vanhan ja uuden vaiheen lämpöpitoisuuden ero. Kiteytymisen päätyttyä järjestelmään jää vain yksi kiinteä faasi, toisin sanoen lämpötila voi jälleen muuttua (laskea) muuttamatta faasien lukumäärää.
Tilakaaviot kuvaavat järjestelmän vaihekoostumusta komponenttien eri pitoisuuksilla X, lämpötilat Tja paine P... Tilakaaviot ovat yleensä spatiaalisia. Avaruuden ulottuvuus riippuu riippumattomien muuttujien määrästä, joiden funktio on vaihekoostumus. Nämä muuttujat ovat koordinaatit, joihin kaavio on rakennettu. Yksinkertaisin vaihekaavion tyyppi kuvaa puhtaan yksikomponenttisen materiaalin tilaa paineen ja lämpötilan funktiona, esimerkiksi tunnettu kaavio veden tilasta. Emme kuitenkaan ota huomioon tällaisia \u200b\u200byksikomponenttisia järjestelmiä, vaan jatkamme välittömästi monikomponenttisten järjestelmien tarkastelua, koska puolijohteiden saamiseksi käytetään monikomponenttikaavioita. Useimmiten tällaiset kaaviot piirretään lämpötilan ja pitoisuuden koordinaateihin ( T− X). SISÄÄN
tässä tapauksessa binaarijärjestelmissä (kaksikomponenttiset) kaaviot on esitetty tasossa. Kolmikomponenttisissa (kolmikomponenttisissa) järjestelmissä kaaviot rakennetaan kolmiulotteiseen tilaan jne. Jos lämpötilan lisäksi paine on myös muuttuja, niin binäärisysteemeissä kaavioista tulee kolmiulotteisia ( P− T− Xkaaviot). Seuraavassa tarkastelemme pääasiassa vain koordinaateissa rakennettuja binäärituotteita T− X... Tämä luku kattaa kuitenkin myös ja P− T− Xkaaviot joistakin puolijohdebinaarijärjestelmistä, joilla on suuri käytännön merkitys.
Tyypillisesti kaavioiden pitoisuus ilmaistaan \u200b\u200byhden komponentin painona tai moolijakeina tai atomiprosentteina. Siksi pitoisuuden alue muuttuu akselille piirrettynä X, on rajoitettu ja ulottuu nollasta yhteen tai 100 prosenttiin. Puolijohdejärjestelmissä yhdessä lineaariselle asteikolle rakennettujen kaavioiden kanssa rakennetaan joskus kaavioita, joissa komponentin pitoisuus kerrostuu atomina kuutiosenttimetriä kohti tai atomiprosentteina, mutta käytetään logaritmista asteikkoa. Tämä johtuu siitä, että pääsääntöisesti rajoittava liukoisuus (ks. Luku 7)

Kuva: 4.3. Si-Au-järjestelmän vaihekaavio eri asteikoilla pitoisuusakselia pitkin (puolijohteen vieressä olevalla alueella lejeerauskomponentin atomiprosentit piirretään logaritmisella asteikolla ja sitten pitoisuus atomiprosentteina piirretään lineaarisella asteikolla).
kiinteiden puolijohteiden elementtien (epäpuhtauksien) määrä on pieni (alle 0,1 at.%) Ja tosiasiallisesti käytetty doping pitoisuutena on 1015–1019 atomia / cm3, toisin sanoen 10–5–10–2 at.% (Katso kuva 4.3) ).
Tilavaihekaaviot antavat tietoa vaiheiden luonteesta ja järjestelmän faasikoostumuksesta, kun yhden tai useamman komponentin pitoisuus, lämpötila ja paine muuttuvat. Käyttämällä näissä olosuhteissa tasapainotilakaavioita voidaan määrittää: 1) vaiheiden lukumäärä järjestelmässä; 2) kunkin faasin koostumus, luonne (alkuaine, yhdiste, kiinteä liuos) ja olosuhteet, joissa se muodostuu; 3) kunkin vaiheen suhteellinen määrä.
Vaihekaaviot rakennetaan fysikaalisten ja kemiallisten analyysitietojen perusteella. Tämä analyysi perustuu kokeelliseen tutkimukseen fysikaalisten ominaisuuksien riippuvuudesta parametreista, kuten konsentraatiosta, lämpötilasta, paineesta. Näiden riippuvuuksien tuntemus antaa mahdollisuuden määrittää vaiheiden luonne ja niiden olemassaolon rajat. Yleisimmät tilakaavioiden piirtämiseen käytetyt menetelmät ovat termografiset ja dilatometriset menetelmät. Niiden ydin on siinä, että tietyn koostumuksen seokselle faasimuunnosten lämpötilat määrää entalpian äkillinen muutos H(lämpöpitoisuus) tai tilavuus Vjärjestelmä, joka on kiinnitetty käyriin lämpötila-aika (lämpötila ilmoitetaan säännöllisin väliajoin) tai lämpötila-tilavuus seoksen jäähdytys- tai lämmitysprosessissa. Kun täten on määritetty vaihemuutoskohdat tietyn järjestelmän eri koostumusten seoksille, on mahdollista rakentaa koko vaihekaavio. Nämä menetelmät määrittävät vain ensimmäisen tyyppiset vaihemuutokset. Nämä siirtymät tulisi erottaa toisen asteen vaihemuutoksista (ferromagneettinen - paramagneettinen tila, suprajohtava - ei suprajohtava, järjestetty - häiriintynyt), joihin liittyy hyppimäinen muutos puristuskertoimessa ja ominaislämmössä. Tässä tapauksessa rakennetaan koostumus-ominaisuuskaaviot tai annetulle koostumukselle lämpötila-ominaisuuskaaviot jne.